|
Sole wokół nas |
|
|
|
Kalcyt
Chlorek
Sodu
Siarczan(VI)
sodu
Węglan sodu
Anhydryt
Nadmanganian
potasu
Saletry
|
|
|
|
Kalcyt
- Wzór chemiczny: CaCO3 (węglan wapnia)
- Twardość w skali Mohsa: 3, bardzo kruchy
- Łupliwość: doskonała (trójkierunkowa)
- Gęstość: 2,6-2,8 g/cmł
- Barwa: bezbarwny lub różne barwy (biały, szary)
- Połysk: szklisty, perłowy
- polany kwasem solnym HCl - burzy się
- trudno rozpuszczalny w wodzie, dobrze w wodzie nasyconej
CO2
Tworzy kryształy izomeryczne, tabliczkowe, słupkowe, igiełkowe. Często
wykształca bliźniaki oraz zrosty wielokrotne. Odznacza się bogactwem
postaci - znanych jest ponad 2000 form jego kryształów i
kombinacji. Najczęściej przyjmuje postać romboedrów i skalenoedrów.
Często tworzy naskorupienia, naloty, żyły. Jest izostrukturalny z
magnezytem, rodochrozytem, syderytem. Jest kruchy, przezroczysty, często
zawiera domieszki: manganu - manganokalcyt; żelaza i magnezu -
kalcyt magnezowy; strontu - stroncjokalcyt; baru i kobaltu -
kobaltokalcyt; ołowiu - plumbokalcyt. W czystych kryształach
kalcytu (szpat islandzki) można zaobserwować zjawisko podwójnego
załamania światła.
|


|
|
|
| |
|
|
Chlorek sodu (NaCl) - nieorganiczny związek
chemiczny, sól kwasu chlorowodorowego i sodu, stanowiący podstawowy
składnik soli kuchennej i soli warzonej. Woda morska to roztwór chlorku
sodu.
| Ogólne informacje |
| Nazwa
systematyczna |
chlorek sodu |
| Inne nazwy |
sól sodowa kwasu chlorowodorowego, sól, sól kuchenna |
| Wzór
chemiczny |
NaCl |
| Masa molowa |
58,44 g/mol |
| Wygląd |
białe kryształy |
| Numer CAS |
7647-14-5 |
| Właściwości |
| Gęstość i stan
skupienia |
2,16 g/cm3 (2 160 kg/m3), ciało
stałe |
| Rozpuszczalność
w wodzie |
360 g/dm3 |
| Temperatura
topnienia |
801°C (1 074 K) |
Chlorek sodu jest białą substancją krystaliczną, dobrze rozpuszczalną w
wodzie, jednak o niewielkim stężeniu maksymalnym, słabo
higroskopijną.
Krystalizuje w układzie regularnym.
Głównym surowcem do pozyskania chlorku sodu jest sól kamienna, nazywana
w mineralogii halitem. Halit jest pozyskiwany głównie metodami kopalnymi.
Otrzymuje się go także poprzez odparowanie wody morskiej.
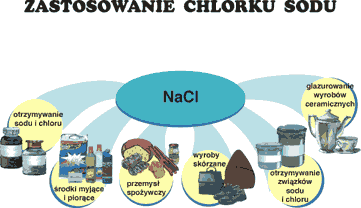
To chlorek sodu powoduje, że woda morska jest słona. Wchodzi także w
skład płynu pozakomórkowego organizmów żywych. W kuchni jest używany do
solenia potraw (przyprawa), a w przemyśle spożywczym używany jako
naturalny środek konserwujący. Jest również jednym z ważniejszych związków
chemicznych w przemyśle chemicznym.
Jest używana podczas zimy do topnienia lodu, gdyż jej roztwór ma niższą
temperaturę topnienia.
|

http://ptpnoz.free.ngo.pl/d01.jpg


|
|
|
Siarczan(VI)
sodu, tetraoksosiarczan(VI) sodu,
siarczan(VI) dwusodu,
Na2SO4,
bezbarwna substancja krystaliczna, łatwo
rozpuszczalna w wodzie, temperatura topnienia
884°C. W przyrodzie występuje w minerałach i
wodach mineralnych. Jest produktem ubocznym przy
produkcji kwasu solnego. Znajduje
zastosowanie do produkcji środków piorących
(proszek do prania) i farb, ponadto w przemyśle
szklarskim i papierniczym. Tworzy hydraty m.in.
Na 2SO 4.10H 2O
(rozpuszczalny w wodzie) stosowany jest w
medycynie jako osmotyczny lek przeczyszczający
(tzw. sól
glauberska). | | | | |
|
|
|
Węglan sodu
(nazwy zwyczajowe: soda, soda kalcynowana,
soda amoniakalna Na 2CO 3) nieorganiczny
związek chemiczny, sól kwasu węglowego i sodu.
W temperaturze pokojowej jest to biała, higroskopijna substancja, która
topi się w temperaturze 852 °C i dobrze rozpuszcza się w wodzie. Z
roztworu krystalizuje w postaci dużych bezbarwnych kryształów,
wietrzejących na powietrzu.
W przyrodzie związek ten występuje w stanie naturalnym tzw. jeziorach
sodowych oraz w popiele roślin morskich. Stanowi też ważny składnik wielu
minerałów.
Stosuje się go do wyrobu szkła oraz papieru. Wykorzystuje się go
również w produkcji mydła i środków piorących. Jest stosowany do
zmiękczania wody.
Proces wytwarzania sody amoniakalnej składa się z
następujących głównych procesów i operacji:
- przygotowanie roztworów soli
- nasycanie solanki amoniakiem w celu otrzymania solanki amoniakalnej
- wypalanie wapna z kamienia wapiennego z jednoczesnym wytworzeniem
gazów zawierających CO2
- nasycanie solanki amoniakalnej CO2 (karbonizacja)
- oddzielenie kryształów NaHCO3 od ługu macierzystego
- suszenie wilgotnego NaHCO3 i jego rozkład termiczny
(kalcynacja)
- regeneracja NH3 z ługów macierzystych przez zmieszanie z
mlekiem wapiennym i ogrzewanie
|

|
|
|
|
Anhydryt
- Wzór chemiczny: CaSO4
- Barwa : najczęściej bezbarwny, rzadziej biały, szary z
odcieniem niebieskim lub czerwonym (różowym)
- Połysk : szklisty, perłow
- Rysa : biała
- Twardość : 3,0 - 3,5
- Łupliwość : doskonała, wyraźna, trójkierunkowa
- Gęstość : 2,9 - 3,0 g/cm3
- Inne :
- pod wpływem uderzenia rozpada się na podobne do kostek kawałki.
- rozpuszcza się w kwasie solnym i w wodzie.
- wietrzejąc, wchłania wodę i zmienia się w gips; przy czym zwiększa
swoją objętość nawet o 60%.
Tworzy kryształy o pokroju grubotabliczkowym, krótkosłupowym, bądź o
postaci zbliżonej do sześcianu - na ścianach występują charakterystyczne
zbrużdżenia. Często tworzy kryształy zbliźniaczone. Jest kruchy,
przezroczysty; jest minerałem pospolitym, występuje w wielu rejonach
Ziemi.
Występowanie:
Anhydryt
występuje powszechnie w złożach gipsowo-solnych pochodzenia morskiego lub
jeziornego, często w postaci oddzielnych złóż, niekiedy o znacznej
miąższości. Spotykany również w iłach, mułowcach i marglach. Jest
produktem ewaporacji (odparowania) wody morskiej lub dehydracji
(odwodnienia) gipsów.
Zastosowanie:
Stosuje się go w przemyśle
cementowym i do wyrobu kwasu siarkowego. Jako wypełniacz w procesie
produkcji papieru, Szeroko wykorzystywany w budownictwie - tynki,
okładziny, posadzki; wykorzystywany do płuczek wiertniczych. Ma znaczenie
kolekcjonerskie. Znajduje zastosowanie w jubilerstwie oraz jako kamień
ozdobny. Najcenniejsze okazy o barwie purpurowej pochodzą z Kanady i
Szwajcarii. Kryształy szlifowane w formie kaboszonów, nie przekraczają
masy 10 kr. Niezwykle fioletowe kryształy, osiągające długość do 30 cm,
znaleziono podczas budowy tunelu Simplon w Alpach Walijskich
(Szwajcaria/Włochy).
|


|
|
|
|
|
|
|
Nadmanganian potasu (łac. kalium
hipermanganicum; wg obecnej nomenklatury IUPAC manganian(VII)
potasu) - nieorganiczny związek chemiczny sól potasowa kwasu
nadmanganowego o wzorze sumarycznym KMnO4.
Właściwości
W warunkach standardowych jest ciałem stałym o gęstości 2,7
g/cm3. Nie jest higroskopijny. Tworzy charakterystyczne
niebieskofioletowe kryształki. Stosunkowo słabo rozpuszcza się w wodzie (w
temp. 20 °C 6,4 g w 100 cm3). W temp. powyżej 230 °C rozkłada
się zgodnie z równaniem:
2KMnO4 →
K2MnO4 + MnO2 + O2
Jest silnym utleniaczem. Reakcja silnie zależy od pH roztworu. W
roztworach kwaśnych ulega redukcji do słabo zabarwionego
manganu(II):
MnO4- + 8H+ +
5e- → Mn2+ + 4H2O
W roztworach słabo zasadowych i neutralnych redukuje się do tlenku
manganu(IV) (piroluzytu), który wydziela się z roztworu w postaci
brązowego osadu:
MnO4- + 2H2O +
3e- → MnO2 + 4OH-
Natomiast w roztworach silnie zasadowych redukuje się do zielonego
manganianu(VI)
MnO4- + e- →
MnO42-
Nadmanganian potasu posiada silne własności bakterio- i grzybobójcze.
Pastylki tego związku są m.in. stosowane do odkażania wody do mycia, w
maściach do odkażania gardła oraz w preparatach do odkażania ran.Roztwór
nadmanganianu potasu z uwagi na właściwości utleniające, jest stosowany w
analizie chemicznej do wykrywania jonów redukujących, takich jak
tiocyjaniany (rodanki, SCN-), bromki, azotany(III).
Roztwór
ten jest również stosowany w analizie ilościowej, do miareczkowania - jest
to manganianometria.
Roztwory wodne nadmanganianu potasu posiadają, w
zależności od stężenia, barwę od jasnoczerwonej do ciemnofioletowej, przy
czym barwa pojawia się już przy bardzo małych stężenia tego związku.
Podgrzewanie roztworu wodnego nadmanganianu potasu prowadzi do jego
dekompozycji do ditlenku manganu, co jest związane z jego
odbarwieniem.
Zastosowanie
Nadmanganian potasu dawniej stosowano jako środek
przeciwgrzybiczny. Niegdyś popularne były kąpiele niemowląt w roztworze
nadmanganianu, obecnie nie jest to już praktykowane ze względu na mnogość
innych, skuteczniejszych leków.
Nadmanganian potasu jest czasami stosowany do wykonywania "sztuczki" z
przemianą wody w "wino" i ponownie "wina" w wodę. W tym celu wystarczy na
dnie szklanki umieścić mały, niewidoczny gołym okiem kryształek
nadmanganianu. Po zalaniu go wodą zabarwia się ona czerwono i wygląda jak
"wino", które po podgrzaniu ponownie zmienia się w "wodę". Aby eksperyment
powiódł się, woda powinna być lekko alkaliczna, a szklanka całkowicie
wysuszona.
Można go także wykorzystać do doświadczenia zwanego "lokomotywa". W
probówce umieszczamy kilka średnich kryształków KMnO4 i, za
pomocą pipety, dodajemy trochę perhydrolu. Z probówki natychmiast wylatuje
biały dym (para wodna przemieszana z tlenem). Nadmanganian potasu także
stosuje się w pirotechnice amatorskiej.
Nadmanganian potasu używany jest również do uzdatniania wody pitnej i
sterylizacji narzędzi metodą "polową". Aby uzdatnić wodę należy dodać
nadmanganian potasu do wody w takiej ilości, aby uzyskać odcień
bladoróżowy. Roztwór o odcieniu intensywnie różowym to substancja
odkażająca.
|

Nadmanganian w probówce-kryształki

Roztwór nadmanganianu
|
|
|
Saletra (z łac. sal
petrae - sól skalna) - potoczna nazwa szeregu azotanów o znaczeniu
gospodarczym, saletra znajduje zastosowanie jako nawóz sztuczny. Saletry
są silnymi utleniaczami.
Azotan(V) potasu, znany
także pod nazwami zwyczajowymi saletra potasowa i saletra
indyjska, to sól o wzorze
KNO3. Rozpuszcza się w wodzie (w temperaturze 20° C - 31,6
g/100 cmł; w temperaturze 100° C - 246 g/100 cmł).
Azotan potasu
występuje w przyrodzie w niewielkich ilościach w postaci minerału
nitrokalitu w krajach o suchym, gorącym klimacie, m. in. w Chinach i
Indiach. Z tych państw była sprowadzana do Europy, czemu zawdzięcza nazwę
"saletra indyjska".
Obecnie otrzymuje się ją głównie w reakcji
podwójnej wymiany między azotanem sodu i chlorkiem potasu (strąca się
najtrudniej rozpuszczalny spośród tych soli chlorek sodu):NaNO3
+ KCl → KNO3 + NaCl
Saletra potasowa jest bezbarwnym lub białym, krystalicznym ciałem
stałym. Dobrze rozpuszcza się w wodzie (w temp. 20°C 31,6 g/100
cm3, w temp. 100°C 246 g/100 cm3). Jej temperatura
topnienia wynosi 334°C. Przy ogrzaniu do 400°C rozkłada się na azotan(III)
potasu i tlen:
2KNO3 → 2KNO2 + O2
Saletra potasowa jest utleniaczem.
Zastosowanie
- Z tego powodu jej głównym zastosowaniem przez wieki była produkcja
czarnego prochu. Mimo upływu lat, jest nadal stosowana w pirotechnice
jako utleniacz.
- Do początków XX w. azotan potasu był używany do otrzymywania kwasu
azotowego.
- Obecnie jest stosowany głównie do produkcji azotanu(III) (azotynu)
potasu, do nitrowania,
- używany jako nawóz (zawiera 13% azotu i 45% tlenku potasu), a także
- do konserwowania mięsa (E252). Jego działanie polega na wydzielaniu
azotynu potasu).
- Po zmieszaniu z sacharydem, np. sacharozą w proporcjach
stechiometrycznych tworzy substancję łatwopalną o temperaturze zapłonu
ok. 400°C, osiąga temperaturę 600°C i wytwarza dużo dymu.
- Dodatkowo w połączeniu ze sproszkowanym pyłem metalu i ew. dodatkami
jest używana do produkcji mas pirotechnicznych, fotobłysków, czyli
krótkich i bardzo jasnych impulsów świetlnych, mających głównie
zastosowanie w tzw. petardach.
- Po nałożeniu go (napisaniu czegoś) na ręcznik papierowy, wysuszeniu
i zapaleniu, na przykład rozgrzanym drucikiem, można osiągnąć ciekawy
efekt. Wypalają się tylko pokryte substancją fragmenty ręcznika
papierowego.
Azotan(V) sodu,(inaczej saletra sodowa, saletra chiliska,
NaNO 3) - nieorganiczny związek chemiczny, sól kwasu azotowego i
sodu.
Występuje w przyrodzie w postaci minerału nitronatrytu w krajach o
suchym, gorącym klimacie. Największe jego złoża występują na pustyni
Atacama w Chile - stąd nazwa "saletra chilijska".
Azotan sodu jest
białą lub bezbarwną substancją krystaliczną. Jego właściwości są
analogiczne do azotanu potasu. Dobrze rozpuszcza się w wodzie (w
temperaturze 20°C 88g na 100g H2O). Topi się w temp. 307°C.
Rozkłada się po podgrzaniu do 380°C. Ma właściwości utleniające. Wykazuje
dwójłomność, współczynniki załamania wynoszą no = 1,587 i ne = 1,336 dla długość fali
około 590 nm.
Zastosowania
- przed wynalezieniem przemysłowych metod wiązania azotu z powietrza
(metoda Mościckiego, metoda Habera i Boscha) azotan sodu był używany do
uzyskiwania kwasu azotowego
- obecnie używa się go do produkcji azotanu potasu
- do produkcji materiałów wybuchowych
- jako nawóz azotowy (zawiera 15,5% azotu), a także
- do konserwowania mięsa (przeciwdziała tworzeniu się jadu
kiełbasianego; symbol UE - E251)
- używa się go także do produkcji mieszanin pirotechnicznych.
Otrzymywanie
Można go otrzymać działając kwasem azotowym(V) na węglan
sodu:
Na2CO3 + 2HNO3 →
2NaNO3 + H2O +
CO2↑
|
|
|
| |
|
|
|
|
|
| |
|
|
|
|
|
|










