|
Kwas Węglowy |
||||
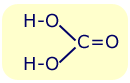
| Kwas węglowy (H2CO3, poprawniej H2O*CO2) to tlenowy kwas nieorganiczny. Występuje jedynie w wodnych roztworach dwutlenku węgla (nie jest możliwe uzyskanie czystego kwasu). | ||||
| Otrzymywanie Kwas węglowy otrzymujemy łącząc dwutlenek węgla z wodą: H2O + CO2 → H2CO3 W praktyce jednak, rozpuszczenie nawet znacznej ilości dwutlenku węgla w wodzie prowadzi do otrzymania niewielkiego stężenia tego kwasu, ze względu na to, że równowaga powyższej reakcji jest silnie przesunięta w stronę substratów. Właśnie to zjawisko jest odpowiedzialne za lekko kwaśny smak tzw. wody sodowej. Nieco większe stężenie tego kwasu można uzyskać poprzez rozkład wodorowęglanu sodu w wodzie. |
|
|||
|
Właściwości i zastosowanie Kwas ten jest kwasem bardzo nietrwałym, już w temperaturze pokojowej ulega reakcji rozkładu. Efektem tego jest fakt, iż nie można otrzymać stężonego roztworu tego kwasu. Kwas węglowy służy do produkcji napojów gazowanych - przykładem może być woda sodowa. |
||||
|
Dysocjacja W roztworach dysocjuje dwustopniowo - może stracić jeden lub dwa protony. Po oderwaniu jednego protonu powstaje jon wodorowęglanowy (HCO3-), po oderwaniu dwóch - jon węglanowy (CO32-): H2CO3 → HCO3- + H+ (pKd = 6.35) HCO3- → CO32- + H+ (pKd = 10.33)
|
||||
| Kwas węglowy a
zasady Z zasadami kwas węglowy tworzy sole, odpowiednio - węglany lub wodorowęglany. Najważniejsze sole tego kwasu to wodorowęglan sodu NaHCO3 (popularnie zwany sodą kuchenną), węglan wapnia CaCO3 (kalcyt, kreda), węglan amonu NH4CO3. |
||||