 |
||||||||||||||||||||||||||
|
Reakcje otrzymywania soli |
||||||||||||||||||||||||||
Reakcje:
NaOH + CH3COOH
→
CH3COONa + H2O
Wodorotlenki typu Me(OH)y.
Z uwagi, że metale znajdują
się głównie w grupach od 1
do 13 (w grupie 2 od magnezu
w dół, w grupie 13 od glinu
w dół), można przyjąć, że y
jest równe numerowi grupy
dla grup od 1 do 3, oraz 3
dla grupy 13. Dla
pozostałych metali (grupy od
3 do 12) wodorotlenki
tworzone są tylko dla jonów
o najniższym stopniu
utlenienia (przeważnie na
+2).
Fe + 2HCl
→
FeCl2 + H2
Przyglądając się tej reakcji
otrzymywania soli, wydaje
się ona być bardzo prostą.
Jednakże należałoby wziąć
pod uwagę reaktywność
metali. Wszystkie metale
zostały ułożone w pewien
szereg, zwany szeregiem
napięciowym metali a czasami
szeregiem reaktywnośc.
Najbardziej reaktywne metale
to te, które bardzo chętnie
reagują i znajdują się na
początku tego szeregu. Pod
koniec szeregu znajduje się
wodór, który jak nam wiadomo
nie jest metalem i oddziela
pozostałe metale od metali
szlachetnych (Cu, Ag, Hg,
Pt, Au). Z szeregu
napięciowego metali można
wywnioskować, że:
♦ metal który jest bardziej reaktywny czyli leży wyżej w szeregu, jest w stanie wyprzeć metal mniej reaktywny z jego soli i go zastąpić. Metal bardziej reaktywny utleni się, a ten mniej reaktywny ulegnie redukcji. ♦ prawidłowość ta dotyczy również wodoru a co za tym idzie, tylko metale, które w szeregu napięciowym leżą nad wodorem są w stanie wyprzeć wodór z kwasu. Innymi słowy, tylko metale reaktywne (nieszlachetne) reagują z kwasem wydzielającym wodór. Metale szlachetne albo wcale nie reagują z kwasami (kwasy beztlenowe), albo reagują w sposób, który redukuje atom centralny kwasu. Metale reaktywne reagują czasami bardzo gwałtownie z kwasem i zamiast wydzielania się wodoru, obserwujemy również redukcje atomu centralnego. Przykładem tego może być reakcja glinu lub cynku z rozcieńczonym kwasem azotowym. Może się również zdarzyć, że metale reaktywne ulegają pasywacji. Najbardziej taką znaną reakcją jest reakcja glinu ze stężonym kwasem azotowym, gdzie glin pokrywa się ściśle przylegającym do powierzchni metalu tlenkiem glinu i jego dalsza reakcja nie jest możliwa). oraz reakcja ołowiu ze stężonym kwasem siarkowym, gdzie ołów pokrywa się siarczanem ołowiu, który nie dopuszcza kwasu siarkowego do powierzchni metalu. Cu + HCl → reakcja nie zachodzi (miedź w szeregu aktywności metali leży za wodorem) Al + HNO3 stęż. → reakcja nie zachodzi Pb + H2SO4 stęż. → reakcja nie zachodzi 3. Tlenek metalu + kwas =Sól + Woda CuO + 2HCl
→
CuCl2 + H2O
Tlenki metali z grup od 1 do
13 bo tam głównie znajdują
się metale mogą reagować z
kwasami, przy czym w grupach
od 4 do 12, tylko tlenki na
najniższych stopniach
utlenienia.
Zn + Cl2
→ ZnCl2
Metoda ta stosowana może
być do otrzymywania
większości soli kwasów
beztlenowych. Niektórych
z nich nawet nie można
otrzymać inną drogą.
Przykładem tego jest
siarczek glinu, który w
wodzie natychmiast
hydrolizuje do
wodorotlenku glinu i
siarkowodoru:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S 5. Tlenek metalu + Bezwodnik kwasowy (tlenek niemetalu)= Sól CaO + CO2
→
CaCO3
Bezwodnik kwasowy - czyli
tlenek, który rozpuszczony w
wodzie tworzy kwas, a więc
musi to być tlenek
niemetalu, ewentualnie
tlenek metalu na najwyższym
stopniu utlenienia (patrz
reakcje tlenek metalu +
wodorotlenek )
6.Tlenek Kwasowy+ Zasada = Sól + Woda Ca(OH)2 + CO2
→
CaCO3 + H2O
Tlenki pierwiastków z grup
od 14 do 17, oraz tlenki
metali na najwyższym stopniu
utlenienia
7. Sól1 + kwas1 = Sól2 + Kwas2 Na2CO3 +
2HCl
→
2NaCl + CO2 + H2O
Warunkiem zajścia tej
reakcji jest użycie mocnego
kwasu i soli słabego kwasu.
Mocne kwasy możemy poznać po
tym, że atom centralny jest
w nich na najwyższym stopniu
utlenienia. Innym czynnikiem
pozwalającym ocenić moc
kwasu jest wielkość różnicy
z-x dla kwasu
opisanego ogólnym wzorem
HxEOz:
Dla kwasów beztlenowych, w układzie okresowym, moc ich rośnie wraz ze wzrostem numeru grupy i numeru okresu. 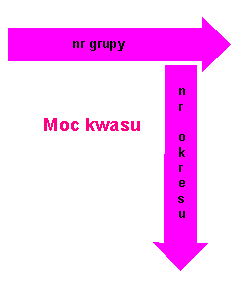 Oto przykład wzrostu mocy
kwasów w szeregu: 8. Sól1 + Zasada1 = Sól2 = Zasada2
CaCl2 + NaOH→
Ca(OH)2 + 2NaCl AgNO3 + NaCl
→
AgCl + NaNO3
Warunkiem zajścia reakcji
jest wytrącenie się jednej
soli w postaci osadu( Sól3).
Pamiętajmy, że wszystkie
azotany są dobrze
rozpuszczalne w wodzie,
natomiast chlorki z
wyjątkami. Do tych wyjątków
zaliczamy chlorek srebra,
talu, rtęci(I) i ołowiu(II).
Można bez większego błędu
przyjąć, że poza nielicznymi
wyjątkami, sole metali
leżących w 1 grupie są
dobrze rozpuszczalne w
wodzie. |
||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||