 |
|
Elektroliza wodnych roztworów soli |
|
Sole są elektrolitami, czyli w roztworze wodnym ulegają dysocjacji na
jony, czym przewodzą prąd. Jeśli te jony znajdą się w polu elektrycznym
to ich ruch zostanie uporządkowany.
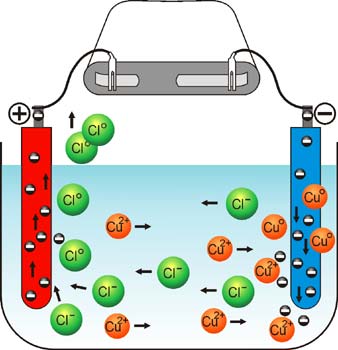
CuCl2 ---> Cu2+ + 2Cl- |
Jony wędrują w kierunku przeciwnie naładowanych elektrod:
- Kationy idą do ujemnej elektrody czyli Katody i tam pobierają elektrony i
rozładowują się:
Katoda Cu2+
+ 2 e- ---> Cu0
- Aniony idą w kierunku dodatniej elektrody Anody i tam zostawiają swój nadmiar elektronów i
rozładowują się
Anoda 2 Cl- - 2 e- ---> Cl2- |
Elektroliza jest procesem stosowanym na skalę przemysłową m.in. do:
- produkcji metali: aluminium, litu, sodu,
potasu
- produkcji rozmaitych związków chemicznych, w tym
aspiryny,
kwasu trifluorooctowego,
wodorotlenku sodu,
potasu,
chloranu sodu i
chloranu potasu
- produkcji gazów:
wodoru
i chloru.
- ładowanie ogniw odwracalnych
- rafinacja metali
- produkcja chloru i wodoru
- pokrywanie przedmiotów warstwą metali
|
 |


