|
||||||||||||||||||||||||
|
Dysocjacja jonowa kwasów |
||||||||||||||||||||||||
|
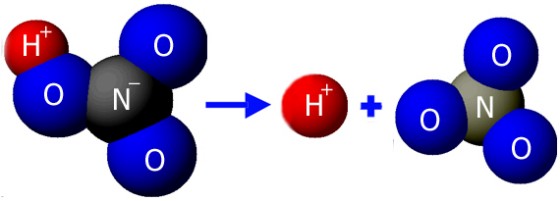
Roztwory wszystkich kwasów
przewodzą prąd elektryczny. Substancje, o takich właściwościach nazywamy
elektrolitami. Pod wpływem wody elektrycznie obojętne cząsteczki
kwasów rozpadają się na jony. Proces rozpadu cząsteczek związków
chemicznych na jony pod wpływem wody nazywamy dysocjacją
elektrolityczną. Jony obdarzone ładunkiem dodatnim to kationy,
a jony obdarzone ładunkiem ujemnym to aniony. Teorię, która
tłumaczy zachowanie się elektrolitów w wodzie opracował szwedzki uczony
Svante Arrhenius. Zgodnie z jego teorią podczas rozerwania wiązania w
cząsteczce kwasu atom wodoru zostaje pozbawiony elektronu walencyjnego -
powstaje kation wodoru. Elektron walencyjny wodoru zostaje przy tzw.
reszcie kwasowej - powstaje anion reszty kwasowej.
Nazwy i wzory reszt kwasowych najważniejszych kwasów przedstawia tabela
|
||||||||||||||||||||||||
|
Dysocjację kwasu solnego można zapisać: |
||||||||||||||||||||||||
 |