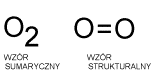|
|||
|
Gazy |
|||
 Dokładna
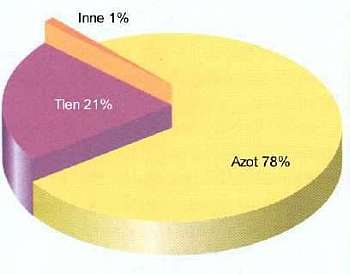
analiza czystego powietrza pozwala na określenie jego składu:
Azot - 78,09% objętościowych
Tlen - 20,94% objętościowych,
Argon- 0,93% objetościowych,
Dwutlenek węgla - 0,03% objętościowych
Wodór - śladowe ilości,
Para wodna - śladowe ilości,
Inne składniki - śladowe ilości, Dokładna
analiza czystego powietrza pozwala na określenie jego składu:
Azot - 78,09% objętościowych
Tlen - 20,94% objętościowych,
Argon- 0,93% objetościowych,
Dwutlenek węgla - 0,03% objętościowych
Wodór - śladowe ilości,
Para wodna - śladowe ilości,
Inne składniki - śladowe ilości,
|
Powietrze Powierzchnia Ziemi otoczona jest powłoką gazową nazywaną atmosferą lub po prostu powietrzem. W czasach starożytnych powietrze uznawane było za jeden z czterech żywiołów. Powietrzem nazywano wówczas każdy gaz. Dopiero na przełomie XVI i XVII wieku polski alchemik Michał Sędziwój przewidział, że powietrze jest mieszaniną różnych gazów. Spostrzeżenia te potwierdziły dopiero badania Antoina Lavioisier, który w 1774 roku dokonał pierwszej analizy tego gazu. Powietrze jest więc mieszaniną wielu gazów, bez barwy, smaku i zapachu. Można je sprężyć, rozprężyć, ogrzać itp. Poprzez silne sprężenie i oziębienie można dokonać skroplenia powietrza. Ciekłe powietrze jest bladoniebieską cieczą o gęstości mniejszej niż gęstość wody. Po raz pierwszy powietrze zostało skroplone w 1883 roku przez polskich profesorów Uniwersytetu Jagiellońskiego: Karola Olszewskiego i Zygmunta Wróblewskiego.
|
||
|
W 1774 roku Anglik Joseph Priestley, ogrzewając promieniami słonecznymi skupionymi przez soczewkę czerwony tlenek rtęci (II) zamknięty w probówce, spowodował rozkład tego związku i wydzielenie tlenu. Prawdopodobnie nieco przed Priestleyem w ten sam sposób tlen odkrył szwedzki aptekarz Karol Sheele. Tlenek rtęci (II) jest toksyczny, więc na potrzeby szkolnych badań laboratoryjnych wykorzystuje się zwykle reakcję rozkładu manganianu (VII) potasu. Nazwa łacińska tlenu to oxygenium. Nazwa ta pochodzi od greckich słów oksy - kwaśny i gennao-rodzę. Stara polska nazwa tlenu, którą nadał mu Jędrzej Śniadecki - kwasoród nawiązuje do nazwy łacińskiej. Nazwę tlen zawdzięczamy J.Oczapowskiemu, uczniowi Śniadeckiego. Tlen jest gazem bez barwy, smaku i zapachu, nieco cięższym od powietrza. Reakcje spalania zachodzą w nim znacznie intensywniej niż w powietrzu, podtrzymuje palenie. W przyrodzie tlen występuje w stanie wolnym (w atmosferze), a także w związkach chemicznych, w skorupie ziemskiej, w wodach rzek, mórz i oceanów a także w organizmach żywych. Tlen jest niezbędny do oddychania, jednak dłuższe oddychanie czystym tlenem może być niebezpieczne. Skroplony tlen jest cieczą o lekko niebieskawym zabarwieniu, wrzącą w temp. -183 stopni Celsjusza. W wodzie tlen rozpuszcza się nieznacznie. Tlen łatwo łączy się z innymi pierwiastkami dając tlenki. Jeśli reakcji tej towarzyszy wydzielanie dużych ilości ciepła i efekty świetlne nazywamy ją spalaniem. Proces łączenia się z tlenem może zachodzić powoli, np. gwóźdź żelazny wystawiony na działanie powietrza i wody stopniowo pokrywa się rdzą. Każdy proces łączenia się pierwiastków z tlenem nazywamy utlenianiem. Odmianą tlenu jest ozon występujący w stratosferze na wysokości 25-50 km nad Ziemią. Warstwa ozonowa chroni nas przed szkodliwym działaniem promieni ultrafioletowych. Ozon jest gazem nietrwałym, o charakterystycznym zapachu, znacznie lepiej rozpuszczającym się w wodzie niż tlen. Działa silnie utleniająco, co znalazło zastosowanie przy dezynfekcji powietrza i wody.
|
|
||
|
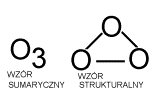
Ozon, tritlen (O3)
- jedna z odmian alotropowych tlenu. Ozon jest niebieskim gazem, cięższym od
powietrza. W stanie wolnym występuje w atmosferze, powstaje w wyniku rozpadu
cząsteczek O2 pod wpływem światła i dalszego łączenia się ich.
Jest gazem niepalnym (ma jednak zdolność, podobnie, jak ditlen - O2,
podtrzymywać proces spalania), dobrze rozpuszczalnym w wodzie. Jest gazem
trującym dla ludzi, zwierząt i roślin. Wykorzystywany jest do wyjaławiania
wody pitnej (ozonowanie), pomieszczeń (szczególnie w szpitalach: lampa
ozonowa), utleniania paliwa rakietowego, a także jako reagent w reakcji
ozonowania. W atmosferze spełnia funkcję filtra pochłaniającego
promieniowanie ultrafioletowe, które emitowane jest przez Słońce.
Pochłanianie to polega na reakcji rozszczepienia (rozpadu) cząsteczki ozonu
na tlen i rodnik tlenowy (odwrócenie reakcji syntezy ozonu). Przerzedzenie
warstwy ozonowej nazywamy dziurą ozonową.
|
|||
|
Saletra amonowa
Erazm Rutherford
|
Jest głównym składnikiem powietrza, jednak nie odgrywa żadnej roli w oddychaniu. Azot jest gazem bezbarwnym, bez smaku i zapachu. Jest lżejszy od powietrza, nie podtrzymuje palenia i słabo rozpuszcza się w wodzie. Azot jest pierwiastkiem mało aktywnym chemicznie. Za odkrywcę azotu uważa się Erazma Rutherforda. Nazwał on ten gaz "zepsutym powietrzem". Nazwa łacińska - nitrogenium- wywodzi się od łacińskiego nitrum - saletra i greckiego gennao - rodzę. Polska nazwa azot pochodzi od greckiego azotikus - nie podtrzymujący życia. Azot występuje w postaci wolnej, a także w postaci wielu związków (np. azotanów nazywanych saletrami). W biosferze azot można spotkać między innymi w białkach i kwasach nukleinowych. Tlenki azotu powstające w procesach przemysłowych są niepożądanymi składnikami atmosfery ziemskiej. W połączeniu z wodą dają kwaśne deszcze.
|
||
|
Argon jest gazem bez smaku i zapachu. Historia odkrycia argonu jest bardzo ciekawa. Okazało się, że azot wydzielony z powietrza był cięższy od azotu uzyskiwanego podczas rozkładu związków chemicznych. Szukając wyjaśnienia tej zagadki angielski chemik W. Ramsay wyodrębnił z azotu pozyskiwanego z powietrza nowy pierwiastek. Nazwano go argonem od greckiego leniwy, nieczynny. Dzięki swojej bierności chemicznej argon jest wykorzystywany wszędzie tam, gdzie chcemy osiągnąć nieczynne chemicznie środowisko. Stosuje się go między innymi do napełniania żarówek w celu ochrony przed spaleniem wolframowego drucika, który żarząc się daje światło. Innymi gazami szlachetnymi występującymi w śladowych ilościach w atmosferze ziemskiej są: hel, neon, krypton i ksenon.
|
|
||
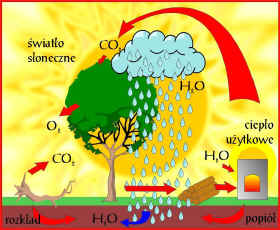 |
Ilość dwutlenku węgla w powietrzu zmienia się w zależności od miejsca na kuli ziemskiej. Ze względu na swoją dużą gęstość występuje głównie w dolnych warstwach atmosfery. Jest to gaz niepalny, bezbarwny, bez zapachu. Dobrze rozpuszcza się w wodzie. Znana wszystkim woda sodowa to właśnie roztwór dwutlenku węgla w wodzie. Z uwagi na to, że dwutlenek węgla jest 1,5 raza cięższy od powietrza i niepalny stosuje się go do produkcji gaśnic. Powłoka gazowa z dwutlenku węgla nie dopuszcza do płonących materiałów powietrza i ogień gaśnie. Dwutlenek węgla wykrywa się za pomocą tzw. wody wapiennej. jej zmętnienie świadczy o obecności dwutlenku węgla. Nie kontrolowana emisja dwutlenku węgla do atmosfery powoduje tzw. efekt cieplarniany. Ziemia nagrzewa się pod wpływem promieniowania słonecznego, warstwa dwutlenku węgla i innych gazów cieplarnianych nie pozwala na wypromieniowanie nadmiaru zgromadzonej energii w kosmos. W ten sposób temperatura na Ziemi podnosi się, powodując zmiany klimatyczne, podnoszenie się poziomu wód, topnienie lodów itp.
|
||
|
Obecności pary wodnej w powietrzu, w słoneczny dzień nie potrafimy odczuć. Jednak zjawiska takie jak rosa, mgła deszcz, czy śnieg potwierdzają jej obecność w atmosferze. Jak wiadomo woda wrze w temperaturze 100°C, jednak parowanie wody zachodzi w każdej temperaturze. Dzięki temu zjawisku oceany, morza i rzeki dostarczają pary wodnej do atmosfery.
|
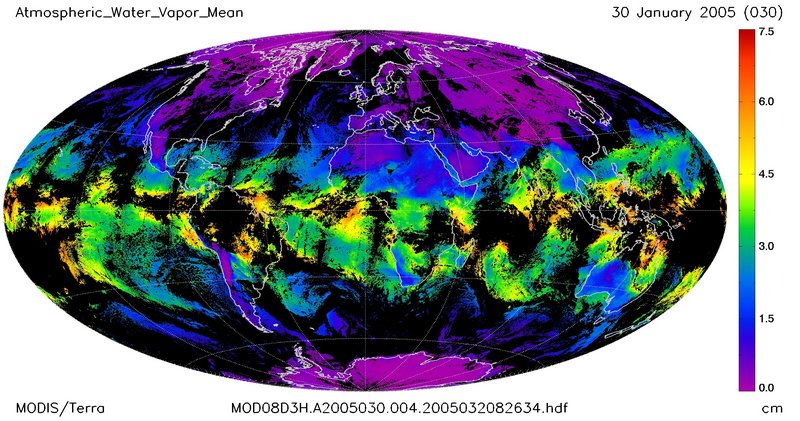 Poziom pary wodnej na świecie |
||
|
Henry Cavendish
MODEL CZĄSTECZKI WODY (TLENKU WODORU):
|
W górnych warstwach powietrza występują niewielkie ilości wodoru. W dolnych warstwach atmosfery ilość wodoru szacuje się na 0,00005%, czyli nie ma go praktycznie wcale. Wodór jest gazem bezbarwnym, bez zapachu i smaku. Jest 14,5 razy lżejszy od powietrza. Ta jego właściwość spowodowała, że był wykorzystywany do wypełniania balonów i sterowców. Nie były to jednak bezpieczne pojazdy, gdyż wodór w mieszaninie z powietrzem tworzy mieszaninę wybuchową. Najbardziej znanym przypadkiem wybuchu i pożaru sterowca była katastrofa Hindenburga na lotnisku w Nowym Yorku w 1937 roku. Zginęło wtedy 35 osób. Po tym wypadku zawieszono loty sterowców. Wodór nieznacznie rozpuszcza się w wodzie. Jest jednym z najtrudniejszych do skroplenia gazów. Łatwo łączy się z tlenem. Wodór został odkryty przez angielskiego uczonego H. Cavendisha w XVIII wieku. Uczony stwierdził, że odkryty prz niego gaz jest palny, a w wyniku jego spalenia powstaje woda. Stąd łacińska nazwa tego pierwiastka Hydrogenium - rodzący wodę. W powietrzu wodór występuje w postaci dwuatomowych cząsteczek. Powietrze zawiera zawsze pewne ilości pary wodnej, różnorodne tlenki, a także zanieczyszczenia stałe, ciekłe i gazowe. Do najczęściej spotykanych zanieczyszczeń powietrza można zaliczyć: dwutlenek siarki, siarkowodór, fluorowodór, tlenki azotu, tlenek węgla, węglowodory, pary, pyły i sadze. Skład pyłów zależy od źródła ich emisji np. w pyłach cementowni występują metale ciężkie, w rolnictwie używa się nawozów sztucznych i środków ochrony roślin, które przedostają się do atmosfery w postaci pyłu. |
||
 |
|||